( قانون شارلز )
قانون شارلز

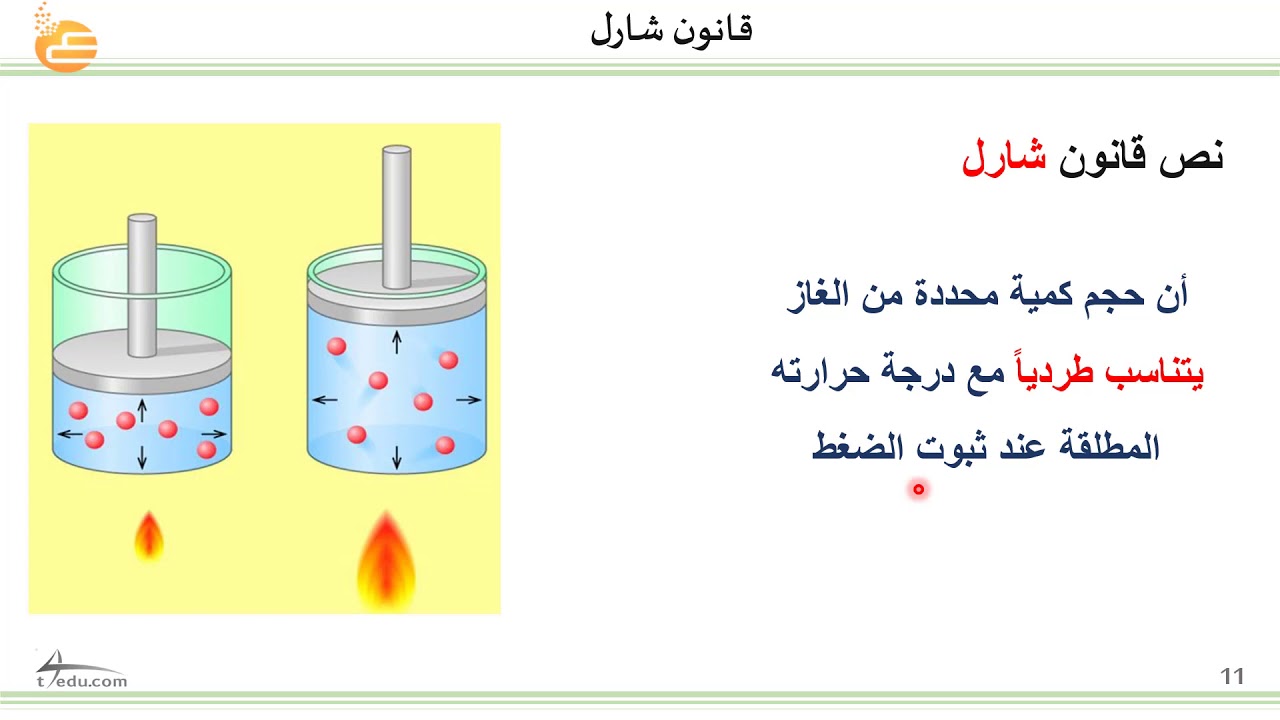
يعبر قانون شارلز عن العلاقة بين حجم الغاز ودرجة حرارته، عند ضغط ثابت. ينص قانون شارلز على أنه “عند ضغط ثابت، يتناسب حجم الغاز تناسبًا طرديًا مع درجة حرارته المطلقة”.
مقدمة
تم اكتشاف قانون شارلز لأول مرة من قبل الفيزيائي الفرنسي جاك ألكسندر تشارلز في عام 1787. وقد أجري تشارلز تجارب على بالون ممتلئ بالهواء، ولاحظ أن حجم البالون يتغير مع تغير درجة الحرارة. ووجد أن حجم البالون يزداد بنسبة 1/273 من حجمه الأصلي لكل درجة مئوية تزداد فيها درجة الحرارة.
الصيغة الرياضية لقانون شارلز


يمكن التعبير عن قانون شارلز رياضيًا بالمعادلة التالية:

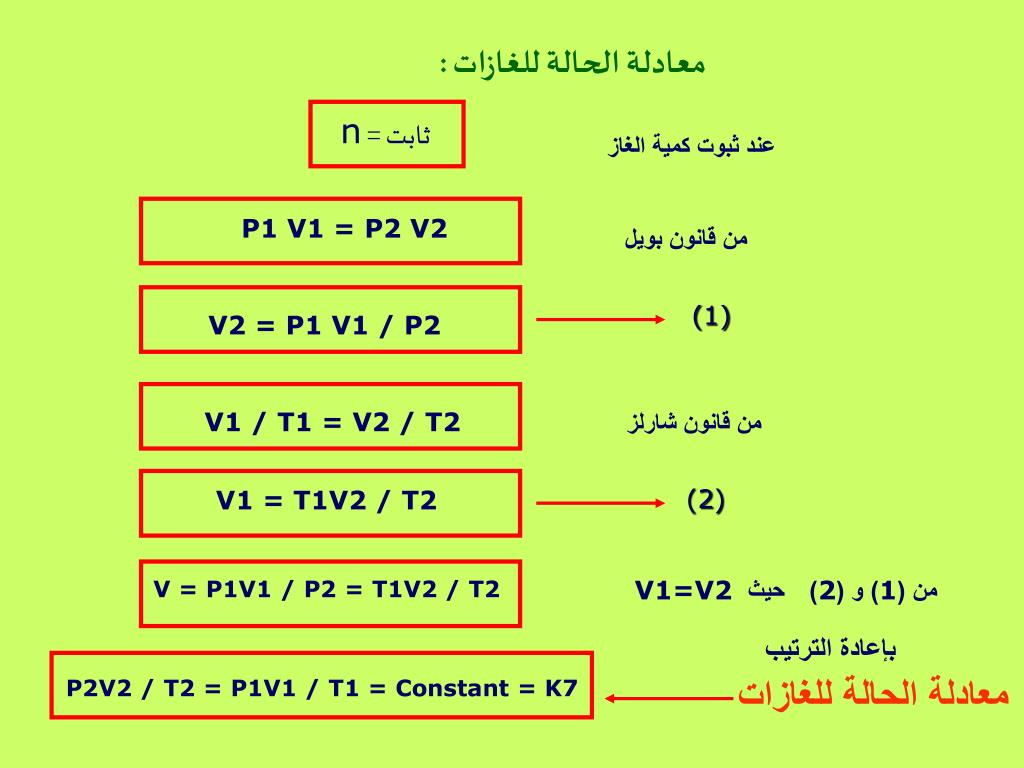
V/T = ثابت
حيث:
- V هو حجم الغاز
- T هي درجة الحرارة المطلقة للغاز

تطبيقات قانون شارلز
لقانون شارلز العديد من التطبيقات العملية، منها:
- قياس درجة الحرارة باستخدام مقياس الحرارة بالغاز
- تحديد حجم الغاز عند درجة حرارة معينة
- تحديد درجة حرارة الغاز عندما يتغير حجمه
الاستنتاج
قانون شارلز هو قانون مهم في فيزياء الغازات. وهو يصف العلاقة بين حجم الغاز ودرجة حرارته، عند ضغط ثابت. يمكن استخدام قانون شارلز لمجموعة واسعة من التطبيقات، بما في ذلك قياس درجة الحرارة وتحديد حجم الغاز ودرجة حرارته.
المصطلحات الأساسية
الغاز المثالي: غاز يتصرف وفقًا لقانون الغازات المثالية.
درجة الحرارة المطلقة: درجة الحرارة التي تقاس بالنسبة إلى الصفر المطلق (-273.15 درجة مئوية).
الحجم: مساحة ثلاثية الأبعاد يشغلها الغاز.
تجارب توضيحية لقانون شارلز
يمكن إجراء العديد من التجارب البسيطة لإثبات قانون شارلز:
التجربة 1:
- املأ بالونًا بالهواء.
- ضع البالون في الثلاجة.
- لاحظ أن حجم البالون يتناقص.
التجربة 2:
- املأ قارورة بالماء الساخن.
- ضع بالونًا فارغًا على فوهة القارورة.
- لاحظ أن البالون ينتفخ.
التجربة 3:
- استخدم حقنة لملء بالون بحجم معين من الهواء.
- اغلق البالون واربطه بخيط.
- علق البالون في غرفة بدرجة حرارة الغرفة.
- استخدم مقياس حرارة لقياس درجة حرارة البالون كل خمس دقائق.
- سجل حجم البالون مقابل درجة الحرارة.
- ارسم رسمًا بيانيًا لحجم البالون مقابل درجة الحرارة.
- لاحظ أن العلاقة بين حجم البالون ودرجة الحرارة خطية.